高一化学《元素周期表、元素周期律》期末练习试题
做好每一份化学试题的练习,是对化学知识的一个学习和巩固的过程。所以,让我们来做一套试题卷吧!下面是小编整理的鲁教版高一化学《元素周期表、元素周期律》期末练习试题以供大家阅读。
鲁教版高一化学《元素周期表、元素周期律》期末练习试题
选择题
碱性位于KOH和Mg(OH)2之间的氢氧化物是( )
A.RbOHB.Al(OH)3
C.LiOHD.NaOH
W、X、Y、Z 4种短周期元素在元素周期表中的位置如图所示,其中Z位于ⅦA族。下列判断错误的是( )

A.W、Y可形成两种不同的化合物
B.Z的阴离子电子层结构与氩原子的相同
C.W的氢化物的沸点比Y的氢化物的沸点高
D.Y元素的非金属性比X元素的非金属性强
元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族元素的原子,最外层电子数相同,化学性质完全相同
运用元素周期律分析下面的推断,其中错误的是( )
A.铍(Be)是一种轻金属,其氧化物对应的水化物可能具有两性
B.砹是一种有色固体,HAt很不稳定,AgAt是有色难溶于水且感光性很强的固体
C.第三周期元素的离子半径从左到右依次减小
D.硫酸锶(SrSO4)是难溶于水和盐酸的白色固体
在元素周期表中位于金属元素和非金属元素交界处最容易找到的材料是( )
A.制催化剂的材料
B.耐高温、耐腐蚀的合金材料
C.制农药的材料
D.半导体材料
我国最新报道的高温超导体中,铊(Tl)是组成成分之一,已知铊与铝是同主族元素。下列关于铊的性质判断中,可能错误的是( )
A.是银白色金属
B.能生成+3价化合物
C.氢氧化铊与氢氧化铝一样是两性氢氧化物
D.Tl可能与水反应生成H2
砹是原子序数最大的卤族元素,推测砹的化合物不可能具有的性质是( )
A.砹是有色固体B.砹化氢很稳定
C.砹易溶于有机溶剂D.砹化银不溶于水
“北大富硒康”中含有微量元素(Se),对人体有保健作用。已知硒为第4周期ⅥA族元素,根据它在周期表中的位置推测硒不可能具有的性质为( )
A.硒化氢很稳定
B.硒化氢的水溶液显弱酸性
C.得电子能力强于硫
D.其最高价氧化物的水化物酸性强于砷弱于溴
填空题
碱金属元素在科学研究和生产生活中有着广泛用途。

(1)锂是最轻的金属,如果用锂做一架飞机,两个人就可以抬动。锂在元素周期表中的表示如图所示,填写以下空格。
①Li在元素周期表中的位置:________。
②6.941的意义:____________________________________。
(2)光电管是利用碱金属铯受到光照射时能形成电流这一光电效应的性质制成的。
①完成铯的原子结构示意图:
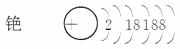
②下列有关铯的说法正确的是________。
A.其单质在常温下与水反应不如钠剧烈
B.其原子半径比钾原子半径小
C.其氢氧化物的水溶液不能使氢氧化铝溶解
D.其碳酸盐易溶于水
推断题
有X、Y、Z三种元素,其中X、Y属于同一主族,加热时,其单质都能与氢气形成氢化物H2X、H2Y。常温下,X单质为气态,X与Y可形成两种化合物YX2和YX3,Y、Z均在X的下一周期,而Z可与X生成化合物Z2X和Z2X2。试写出:
(1)元素名称X________、Y________、Z________。
(2)化合物Z2X2与H2X反应的化学方程式_________________________。
(3)写出两个由X、Y、Z三种元素所组成物质的化学式________________________。