高一化学必修一第二章复习题及答案
面对高一化学的复习阶段,一套试题能给你带来更大的启发。下面是由小编带来的高一化学必修一第二章复习题及答案,勤于练习总有益处。
高一化学必修一第二章复习题:
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
1。σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠而成。则下列分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是
A.H2 B.HCl C.Cl2 D.F2
2.有关乙炔分子中的化学键描述不正确的是
A.两个碳原子采用sp杂化方式 B.两个碳原子采用sp2杂化方式
C.每个碳原子都有两个未杂化的2p轨道形成π键
D.两个碳原子形成两个π键
3.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。它的分子构型是三角锥形。以下关于PH3的叙述正确的是
A.PH3分子中有未成键的孤对电子 B.PH3是非极性分子
C.PH3是一种强氧化剂 D.PH3分子的P-H键是非极性键
4.碘单质在水溶液中溶解度很小,但在CCl4中溶解度很大,这是因为
A.CCl4与I2分子量相差较小,而H2O与I2分子量相差较大
B.CCl4与I2都是直线型分子,而H2O不是直线型分子
C.CCl4和I2都不含氢元素,而H2O中含有氢元素
D.CCl4和I2都是非极性分子,而H2O是极性分子
5.下列事实中能证明氯化氢是共价化合物的是
A.液态氯化氢不导电 B.氯化氢极易溶于水
C.氯化氢不易分解 D.氯化氢溶液可以电离
6.下列现象与氢键有关的是:
①NH3的熔、沸点比VA族其他元素氢化物的高 ②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小 ④尿素的熔、沸点比醋酸的高
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 ⑥水分子高温下也很稳定
A.①②③④⑤⑥ B.①②③④⑤ C.①②③④ D.①②③
7、下列说法不正确的是
A.元素的第一电离能(I1)是元素的单质失去最外层1个电子所需要吸收的能量,同周期从左到右元素的I1逐渐增大。
B.元素的电负性是衡量元素在化合物中吸引电子能力大小的一种标度,同主族从上到下元素的电负性逐渐减小。
C.含有阴离子的晶体中一定含有阳离子,含有阳离子的晶体中不一定含有阴离子。
D.原子晶体中一定含有共价键;离子晶体中一定含有离子键,可能含有共价键;分子晶体中一定存在分子间作用力。
8.在乙烯分子中有5个σ键、一个π键,它们分别是
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间是sp2形成的σ键,C-C之间未参加杂化的2p轨道形成的是π键
D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键
9.已知磷酸分子
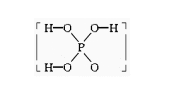
中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换,又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换,由此可推断出H3PO2的分子结构是
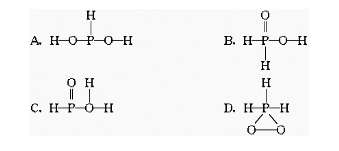
10.氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
D.氨气分子是极性分子而甲烷是非极性分子。
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。)
11.有关苯分子中的化学键描述正确的是
A.每个碳原子的sp2杂化轨道中的其中一个形成大π键
B.每个碳原子的未参加杂化的2p轨道形成大π键
C.碳原子的三个sp2杂化轨道与其它形成三个σ键
D.碳原子的未参加杂化的2p轨道与其它形成σ键
12、下列说法不正确的是
A.互为手性异构体的分子互为镜像 B.利用手性催化剂合成可主要得到一种手性分子
C.手性异构体分子组成相同 D.手性异构体性质相同
13、下列配合物的配位数不是6的是
A、K2[Co(NCS)4] B、Na2[SiF6] C、Na3[AlF6] D、[Cu(NH3)4]Cl2
14、已知Zn2+的4s轨道和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2-的空间构型为
A、直线形式上 B、平面正方形 C、正四面体形 D、正八面体形
15、下列物质不能溶于浓氨水的是
A、AgCl B、Cu(OH)2 C、AgOH D、Fe(OH)3
16.最近,中国科大的科学家们将C60分子组装在一单层分子膜表面,在—268℃时冻结分子的热振荡,并利用扫描隧道显微镜首次“拍摄”到能清楚分辨碳原子间单、双键的分子图像。下列化合物分子中一定既含单键又含双键的是
A.CO2 B.C2H4O C.COCl2 D.H2O2
17. .[双选题]下列描述中正确的是( )
A.CS2为V形的极性分子 B.CIO2的空间构型为平面三角形
C.SF6中有6对完全相同的成键电子对 D.SiF4和SO3的中心原子均为sp3杂化
18.下列各组分子中,都属于含极性键的非极性分子的是
A. CO2 H2S B. C2H4 CH4 C. C60 C2H4 D.NH3 HCl
19.三氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,它能水解,有关叙述正确的是
A.三氯化硼液态时能导电而固态时不导电 B.三氯化硼加到水中使溶液的pH升高
C.三氯化硼分子呈正三角形,属非极性分子 D.三氯化硼遇水蒸气会产生白雾
20、关于氢键,下列说法正确的是
A.每一个水分子内含有两个氢键 B.冰、水和水蒸气中都存在氢键
C.DNA中的碱基互补配对是通过氢键来实现的
D.H2O是一种非常稳定的化合物,这是由于氢键所致
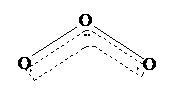
21、1994年度诺贝尔化学奖授予为研究臭氧做出贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3的分子结构如图,呈V型,两个O----O键的夹角为116.5o。三个原子以一个O原子为中心,另外两个O原子分别构成一个共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键------三个O原子均等地享有这个电子。请回答:
(1)臭氧与氧气的关系是
(2)写出下列分子与O3分子的结构最相似的是
A.H2O B. CO2 C.SO2 D. BeCl2
(3)分子中某原子有一对或几对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有 对孤对电子。
(4)O3分子是否为极性分子 。(填是或否)
(5)O3具有强氧化性,它能氧化PbS为PbSO4而O2不能,试配平:
PbS + O3 ==== PbSO4 + O2
生成1mol O2的转移电子物质的量为 mol。
22、(10分)W、X、Y、Z四种元素的原子序数依次增大。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;X原子的L电子层中未成对电子数与Y相同,但还有空轨道;W、Z的原子序数相差10,且Z原子的第一电离能在同周期中最低。
(1)写出下列元素的元素符号:W ,X ,Y ,Z 。
(2)XY分子中,X原子与Y原子都达到8电子稳定结构,则XY分子中X和Y原子用于成键的电子数目分别是 ;根据电子云重叠方式的不同,分子里共价键的主要类型有 。
(3)XY2与ZYW反应时,通过控制反应物的物质的量之比,可以得到不同的产物,相同条件下,在水中溶解度较小的产物是 (写化学式),其原因是该化合物阴离子间可形成二聚离子或多聚链状离子。该化合物阴离子能够相互缔合的原因是:
17.有下列微粒:①CH4 ②CH2=CH2 ③CH = CH ④NH3 ⑤NH4+ ⑥BF3 ⑦P4 ⑧H2O ⑨H2O2填写下列空白(填序号):
(1)呈正四面体的是________。
(2)中心原子轨道为sp3杂化的是________,为sp2杂化的是________,为sp杂化的是________。
(3)所有原子共平面的是________,共线的是________。 (4)微粒存在配位键的是________。
(5)含有极性键的极性分子的是________。
20.第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物。
(1)NH3是一种很好的配体,氨气分子是________(填“极性”或“非极性”)分子,NH3的沸点________(填“高于”“等于”或“低于”)AsH3。
(2)科学家通过X射线测得胆矾结构示意图可简单表示如下:
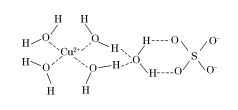
图中虚线表示的作用力为________________。
(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,含有的原子团或分子有:[Cu(NH3)4]2+、NH3、SO42-、H2O,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团或分子是________,其中心原子的杂化轨道类型是________。
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。Ni(CO)4易溶于________(填标号)。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
21.已知X、Y和Z三种元素的原子序

数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为________________,该元素的符号是________。
(2)Y元素原子的价层电子的电子排布图为________________,该元素的名称是________。
(3)X与Z可形成化合物XZ3,该化合物的空间构型为________。
(4)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性、沸点高低并说明理由.
_______________________________________________________________________________________________。
高一化学必修一第二章复习题答案:
选择题答题表
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
答案
B
B
A
D
A
B
A
A
B
C
BC
D
AD
C
D
C
CD
B
CD
C
21、同素异形体 (2)C ( (3)5 (4) 是 (5) 1、4、1、4 2
22、(1)H、C、O、Na (2)2和4,σ键,π键
(3)NaHCO3(1分),因为HCO3—中含有O—H键,相互之间可通过O—H┅O氢键缔合
23.答案:(1)①⑤⑦ (2)①④⑤⑦⑧⑨ ②⑥ ③ (3)②③⑥ ③ (4)⑤ (5)④⑧⑨
[解析]:CH4、NH3、NH4+、P4、H2O、H2O2中心原子各有四对价电子,为sp3杂化,其空间构型分别为正四面体、三角锥、正四面体、正四面体、V形、二面角形。BF3、CH2=CH2的中心原子为sp2杂化,分别为平面三角形、平面形。CH≡CH中心原子为sp杂化,空间构型为直线形。

存在配位键的为NH4+,结构式为
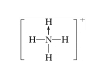
.24.答案:

(1)极性 高于 (2)氢键、配位键 (3)SO4sp3 (4)BC
解析:(1)NH3中氮原子有孤电子对,是极性分子,能形成氢键,所以熔、沸点高;
(2)氧与铜形成的是配位键、H与O形成的是氢键;
(3)SO4中S的孤电子对数=2(6-2×4+2)=0,S与O形成四个σ键,所以S是sp3杂化,SO4为正四面体结构;(4)由立体构型可知是非极性分子,易溶于非极性溶液。
以上便是小编推荐的高一化学必修一第二章复习题及答案全部内容,希望你能喜欢。
高一化学必修一第二章复习题相关文章推荐:
1.新课标高一化学必修1第二章单元测试题 附上答案
2.高一化学必修2第二章复习题及答案
3.高一化学必修2第二章测试题及答案
4.高一必修二化学第二章化学键试题及答案
5.高一化学必修2复习题及答案
6.高一化学必修二复习题及答案
7.高一化学必修1试题及答案
8.高一化学必修2人教版第一章复习题及答案
9.高一化学必修1测试题及答案
10.高一必修一第二章物理练习测试题