高考化学水解知识点
2017-06-01
水有分解和融合材料的双重特性,水解是一种分解技术。水解是一种化工单元过程,是利用水将物质分解形成新的物质的过程。下面小编给你分享高考化学水解知识点,欢迎阅读。
高考化学水解知识点(一)盐类水解实质(从水的电离平衡下手)
盐溶于水电离出的某种离子,与水电离的氢离子或氢氧根离子结合生成弱电解质,使水的电离平衡发生移动。
高考化学水解知识点(二)盐类水解规律
口诀:无弱不水解,有弱才水解,越弱越水解,双弱双水解,谁强显谁性.
解释(1)弱碱强酸盐的水解


高考化学水解知识点(三)正确书写盐类水解的例子方程式
盐类水解属于离子反应,可以按照离子方程式的书写规范,写出正确的离子方程式。例如,硫酸铜水解的离子方程式可按以下三个步骤写出:

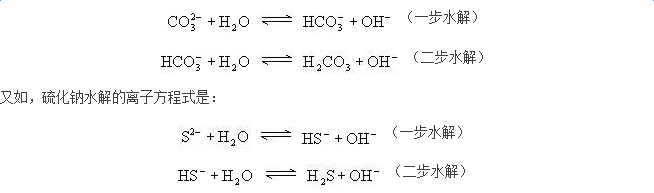
高考化学水解知识点(四)影响盐类水解平衡的因素
盐类水解是个可逆反应,水解过程是个吸热反应,运用平衡移动原理,改变外界条件,便可以控制盐类水解的方向。
(1)温度:升温促使盐类水解,降温抑制水解
(2)浓度:增大盐溶液的浓度,水解平衡向右移动:加水稀释可以促进水解,平衡右移,水解率增大。
(3)酸碱度:向盐溶液中加入H+,可以促进阴离子的水解,抑制阳离子的水解;向盐溶液中加入OH-,可以促进阳离子的水解,抑制阴离子的水解。
猜你感兴趣的:
1.高中化学水解知识点
2.高三化学盐类的水解知识点复习
3.高中化学水解知识点
4.什么是水解 水解的影响因素
5.高中化学必背基础知识点