化学氨气的喷泉实验设计
氨气,Ammonia, NH3,无色气体。有强烈的刺激气味。密度 0.7710。相对密度0.5971(空气=1.00)。易被液化成无色的液体。在常温下加压即可使其液化(临界温度132.4℃,临界压力11.2兆帕,即112.2大气压)。沸点-33.5℃。也易被固化成雪状固体。熔点-77.75℃。溶于水、乙醇和乙醚。在高温时会分解成氮气和氢气,有还原作用。有催化剂存在时可被氧化成一氧化氮。用于制液氮、氨水、硝酸、铵盐和胺类等。可由氮和氢直接合成而制得,能灼伤皮肤、眼睛、呼吸器官的粘膜,人吸入过多,能引起肺肿胀,以至死亡。
高中化学氨气的喷泉实验创新设计
“氨气的喷泉实验”是一个有力证明氨气在常温下极易溶于水且兼有证明其水溶液显碱性的精彩实验。它新奇、有趣。每当出现美丽的喷泉现象时,学生总是好奇、惊羡,它极大地调动了学生的学习兴趣,从而唤起探求新知识的欲望。基于教材的实验效果不理想,笔者在教学实践中尝试性地探索改进方案,终于寻找到一种实验现象明显、可操作性强的氨气喷泉实验新方法。现表述如下,仅供参考。?
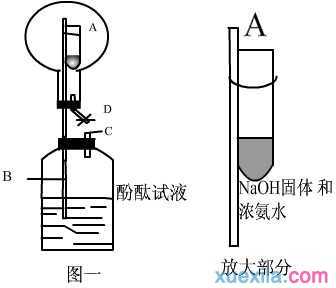
实验装置图:
实验用品:塑料瓶(矿泉水瓶或可乐瓶)、小试管、橡皮筋、尖嘴玻璃管、短玻璃导管、烧瓶、橡胶管、橡皮塞(双孔两个);浓氨水、氢氧化钠固体、酚酞试液、水。
气体的收集:利用浓氨水的挥发性,在浓氨水中加入氢氧化钠固体(或生石灰),氢氧化钠固体溶于浓氨水中放出热量,加速了浓氨水的挥发,迅速放出氨气。
实验操作及现象:①将小试管用橡皮筋固定在尖嘴玻璃管上,塑料瓶中加入适量水,滴入酚酞,振荡。②按上图一安装好实验装置,双手紧握烧瓶检验装置的气密性。③在小试管中加入适量的浓氨水、氢氧化钠固体(或生石灰),迅速伸入烧瓶内,重新安装好装置,观察现象。可以看到小试管中有气泡放出,烧瓶中空气由D处橡胶管排出,烧瓶中空气排完,D处用夹子夹住,多余的氨气会由尖嘴导管排入塑料瓶中,溶于水后便可观察到瓶中酚酞试液变红色。④反应完毕,用一只手的食指按住瓶塞上的短玻璃管C处,另一只手挤压塑料瓶,使少量的水进入烧瓶,即可形成美丽的喷泉。通过堵住C处手指的控制,可调节塑料瓶中进气量,使之产生一定的负压,这样可控制喷泉的大小,延长喷泉持续的时间,突出了实验现象。
实验优点:①把气体的收集和喷泉实验的装置连成一个整体,无需事先收集氨气,操作简单、易于进行,实验成功率高。②可节约时间和药品,整个实验可在5 min内完成;药品用量少,实验可向微型化方向发展。③喷泉可随意控制,延长持续时间、突出了实验现象。