高考化学专项复习:定量实验的考查
一、考查计量仪器的特点和使用
“了解常见仪器的主要用途和使用方法”是《考试大纲》明确提出的一个基本要求。高考中对定量实验涉及的计量仪器的考查主要包括托盘天平、量筒、容量瓶、滴定管、温度计和pH试纸等,从考查的要求看,主要是识记层次,考查学生对常见计量仪器的结构、用途、读数和使用方法的认识。
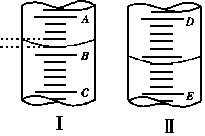
例1、填空
(1)图1表示10 mL量筒中液面的位置,A与B,B与C刻度间相差1 mL, 如果刻度A为4,量筒中液体的体积是________mL。
(2)图II表示50 mL滴定管中液画的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)______________。
A. 是a mL B.是(50-a)mL
C. 一定大于a mL D.一定大于(50-a)mL
解析:本题主要考查量筒和滴定管的结构特点、分度值及读数方法。图I量筒中最小刻度即分度值为0.2 mL,刻度A为4,即B刻度为3,读出3.2 mL。图II中滴定管为50 mL规格,液面以下有刻度部分体积是(50-a)mL,再加上无刻度部分其体积大于(50-a)mL。
二、考查定量实验的基本操作
“用正确的化学实验基本操作,完成规定的‘学生实验’的能力”也是《考试大纲》中对学生实验能力的基本要求。现行高中教材中通过配制一定物质的量浓度的溶液、酸碱中和滴定等基本定量实验的完成,训练学生的基本操作技能,为学生将来参加社会实践或进一步学习打下必要的良好基础,这也是构成人才科学素质的重要组成部分。
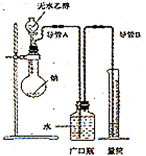
例2、为了确定乙醇分子的结构简式是CH3―O―CH3还是CH3CH2OH,实验室利用图示的实验装置,测定乙醇与钠反应(△H<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目。试回答下列问题:
①指出实验装置的错误_______________。
②若实验中用含有少量水的乙醇代替相同质量的无水乙醇,相同条件下,测得氢气的体积将______(填“偏大”、“偏小”或“不变”)。
③请指出能使实验安全、顺利进行的关键实验步骤(至少指出两个关键步骤)________________。
解析:本实验是将气体的体积转化为水的体积以便于量取,按图示无法达到这一目的,广口瓶中的进气导管不应插入水中,排水导管应插入广口瓶底部。当用含少量水的乙醇时,水也要与钠反应放出氢气,使产生氢气的体积变大。本实验关键在于测定气体体积,操作中应注意检查装置气密性、加入稍过量的钠、从漏斗中缓慢加入无水乙醇。
三、考查实验设计方法
近年来,高考化学试题中对考生设计简单实验能力的考查赋予较多的关注,其中就包括对定量实验的设计的考查,它要求学生能够通过题给实验情境中适当迁移,准确把化学实验基础知识和基本操作技能运用到某些类似的定量实验中去,解决一些原理和操作较简单的定量问题。它充分体现了“源于教材又不拘泥于教材”的命题指导思想,在一定程度上考查了学生的创新思维能力。混合物组分的测定是近年高考对定量实验设计的主要考查内容,从其设计方法上看主要包括重量分析法和滴定分析法。
1、重量分析法
重量分析法就是根据可测量物的重量来确定被测物质组分含量的方法,一般是先使被测组分从试样中分离出来,转化为一定的称量形式,然后用称量的方法测定该成分的含量。根据被测成分与试样中其它成分分离的不同途径,通常应用的重量分析法又分为沉淀法、气化法等。
沉淀法就是利用沉淀反应使被测成分生成溶解度很小的沉淀,将沉淀过滤、洗涤、烘干或灼烧的后成为组成一定的物质,然后称其重量,再计算被测成的含量,这是重量分析的主要方式。
例4、某纯碱试样中含有少量的氯化钠杂质,请设计一个简单的实验,确定纯碱的质量分数。
解析:此题可以根据Na2CO3和NaCl的性质差异,即CO32-和Cl-的不同特性,利用沉淀法设计为:首先将a g试样放入烧杯中加入适量蒸馏水溶解;再向试样的溶液中滴加0.1 mol/L的CaCl2(或BaCl2)溶液,直至不再产生沉淀时为止;过滤、洗涤、干燥并称量所得沉淀物的质量为b g;最终计算出纯碱的质量分数为:。同理向试样的溶液中加入足量稀硝酸和硝酸银盐溶液也可。
(2)气化法是用加热或其它化学方法使试样中被测成分转化为气体逸出,然后根据气体逸出前后的试样重量之差来计算被测成的含量。如“硫酸铜晶体结晶水含量的测定”设计原理中就是利用了气化法。
2、滴定分析法
滴定分析法是传统化学分析法中重要的分析方法之一,是将一种已知其准确浓度的试液滴加到被测物质的溶液中,通过指示剂的变化判断反应完全时,根据所用试剂的浓度和体积求得被测组分的含量。滴定分析法要求发生的反应要完全、反应速率要快、反应要等当量进行、要选择恰当的指示剂。
根据反应类型不同可以分为酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定;根据滴定的方式又可分为直接滴定法、返滴定法、置换滴定法和间接滴定法等。中学化学主要介绍的是酸碱的直接中和滴定。仍以例4为例,该题的设计也可利用滴定法,设计为:先将a g试样溶于蒸馏水配成100 mL待测液;用碱式滴定管准确量取20.0 mL待测液,放入锥形瓶中,滴入二滴甲基橙试液;用c mol/L的标准硫酸溶液进行滴定,记录消耗硫酸的体积;重复上述操作,确立每次消耗硫酸的平均体积为V mL;最后进行计算,即可确定纯碱的质量分数。